
然而,由于CAR T细胞疗法需要将活免疫细胞进行大幅修饰之后重新引入患者体内,因此这些细胞在体内的相互作用可能难以控制和预测。T细胞是“杀伤机器”,可能会损伤携带靶点但是非肿瘤的健康组织(即表达肿瘤相关抗原的正常细胞)。
此外,这些免疫细胞可释放或导致其他细胞释放过量的信号蛋白,即细胞因子,并且可能触发称作细胞因子释放综合征 (cytokine release syndrome, CRS) 的级联效应。CRS可能难以控制,表现为从发热和炎症到器官衰竭甚至死亡的全身症状。77%-93%的白血病患者和37%-93%的淋巴瘤患者在接受CAR T细胞治疗后发生CRS,约50%参与早期CAR T细胞治疗临床试验的患者需要重症监护管理[1]。这些事件不仅给患者造成风险,也会导致试验的失败和延迟,给生物制药研发公司带来时间、财力和商誉等方面的巨大损失。
因此,科学家们需要通过临床前平台进行研究,以便在不危及患者的情况下快速获取可重复且可行的数据结果,从而避免上述风险和试验失败。研究人员可以使用人源化小鼠模型研究CAR T细胞在体内的行为和效应,从而全面了解这些疗法如何以剂量依赖和细胞供体依赖的方式与整个生物系统相互作用。这些信息可以为临床医生和研发人员注入信心,让他们更确信CAR T细胞疗法对每个接受治疗的患者都安全有效,包括临床试验参与者。
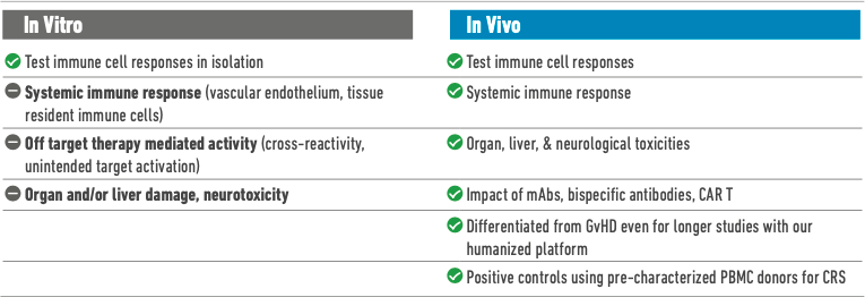
仅凭现有的在人体受试者以外研究CAR T细胞的方法,研究人员无法充分收集群体多样性、系统性相互作用和独特的人类细胞特征,而这些因素都会影响CAR T细胞疗法在临床中的毒性和疗效。本文介绍了每种研究类型固有的限制和挑战,以及如何通过使用免疫人源化小鼠模型克服这些问题并进行体内研究。
体外试验只能“止步于此”
体外CAR T细胞表征分析通常涉及将CAR T细胞与肿瘤细胞和人外周血单核细胞 (PBMC) 共孵育。科学家们可以通过这一过程测量CAR T细胞杀伤单个肿瘤细胞的有效性,以及细胞毒性和细胞因子产生等安全性相关结果。
这些研究相对高效且成本低廉,能够在CAR T细胞发育的早期阶段有效地提供及时反馈。然而,CRS等毒性可通过级联反应影响血液循环以外的系统,而CAR T细胞注射后会最先与循环里的血细胞发生相互作用。考虑这些因素,科学家无法通过体外研究来检测脱靶效应,也无法模拟封闭系统内的器官损伤和神经毒性等下游效应。综上所述,仅凭体外研究无法全面了解CAR T细胞治疗对活体患者的影响。
现有体内模型的局限性
与体外研究不同,体内模型可以大致模拟全身不良反应的下游结果,可供研究人员研究器官效应和检测健康指标(例如总体体重变化)。然而,过去在小鼠、非人灵长类动物 (non-human primates, NHP) 和其他动物中进行的临床前研究未能预测后来在人体受试者中观察到的危险CRS反应,这是因为严重的免疫应答有时可能与人免疫细胞特有的受体表达有关[2]。
将未经修饰的免疫缺陷小鼠直接用于CAR T细胞治疗研究时,这些小鼠无法模拟全身免疫应答。这是因为它们缺乏鼠或人的先天性免疫系统的关键组成,因此没有具有代表性的细胞因子释放水平,也无法表现出其他临床相关表型。
CD34+小鼠可产生人源淋系细胞和髓系细胞,并表现出有效的原发性初级免疫应答,因此是临床前免疫治疗评价的常用模型。然而,在这些模型中,T细胞在胸腺中的成熟接受小鼠主要组织相容性复合物(major histocompatibility complex, MHC)的选择,而非人白细胞抗原(human leukocyte antigen, HLA)。因此,这些小鼠中的人T细胞应答缺乏一定的临床相关性,许多后续下游效应也是如此[3]。
非人灵长类动物试验一直被视为临床前药物安全性和疗效试验的金标准,因为这些动物能最大程度模拟人体生理和疾病进展。然而,非人灵长类动物试验极其昂贵和耗时,并且涉及严重的伦理问题。用体外试验替代NHP可能会遗漏仅在体内发生的细胞非自主毒性相互作用,例如CRS的机制。另一方面,大多数体内临床前模型(如啮齿动物、犬和兔)缺乏人特异性药物靶点,转化价值非常低。此外,现在科学家们可以在人源化小鼠中获得可重复的结果,非人灵长类动物不再是最接近功能性人免疫系统的临床前模拟模型。
为了改进临床前研究并克服上述问题,杰克森实验室 (JAX) 的科学家们开发了一项为期16天的体内试验,在使用预先表征的成人PBMC人源化的小鼠中分析治疗诱导的CRS以及其他反应。
这种人源化小鼠平台是理解功能性人免疫系统面对CAR T细胞给药的应答的理想工具。通过使用小鼠MHC I类和II类缺陷的免疫缺陷NSG小鼠 (NSG-MHC I/II KO) 作为PBMC人源化的遗传背景,有望最大限度地降低异种移植物抗宿主病 (GvHD)的风险,从而让科学家更确信其观察到的任何毒性均由CAR T细胞治疗而非其他混杂因素所致[4]。
科学家们可以通过这一工具观察经HLA选择的人免疫细胞与CAR T细胞之间的反应,这两种细胞均可进入循环并与所有正常器官和生物系统的细胞和组织相互作用。
在先后注射PBMC和给予CAR T细胞或对照治疗后,研究人员可以通过连续测量体重和体温来监测每只小鼠的健康状况,并在关键时间点检测人细胞因子含量。研究人员们还可以在实验结束后采集组织样本,用于研究器官浸润、肝脏毒性、心脏毒性、神经毒性和其他下游效应。此外,也可向PBMC人源化小鼠体内移植肿瘤,从而通过测量肿瘤生长抑制和其它标志物以研究药物毒性和疗效。事实上,肿瘤及其靶分子的存在通常是细胞因子介导全身毒性的必需条件。
PBMC人源化小鼠研究具有诸多优势,除了在与人类生物学的相关性方面优于体内试验以外,其数据质量也优于体外试验。在JAX开展的对标研究中,这些小鼠产生了更具可重复性和更强潜在临床相关性的结果[5]。在以下章节中,我们将探索这种强大工具所蕴藏的研究潜能。
最佳临床前数据:通过单一模型预测疗效和综合毒性
通过单一动物模型研究多个研究问题有助于提高治疗研发管线的效率。验证研究表明,使用PBMC人源化小鼠可快速获得关于给药的高质量数据,表征各种毒性的生物学机制,并且能深入了解导致不同人群产生不同临床反应的因素。
剂量依赖性疗效建模
由于人源化小鼠模型容易接受肿瘤植入,因此研究人员可以借此比较不同CAR T细胞疗法和相同疗法不同剂量的疗效。我们可以通过多个指标来量化疗效,包括直接测量肿瘤生长和观察如体重减轻等健康影响。
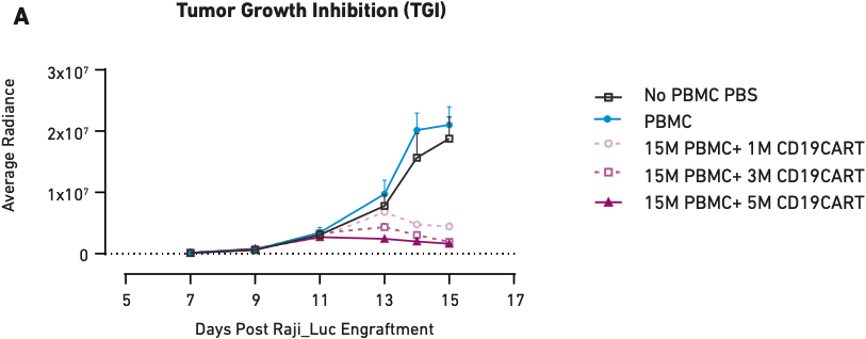
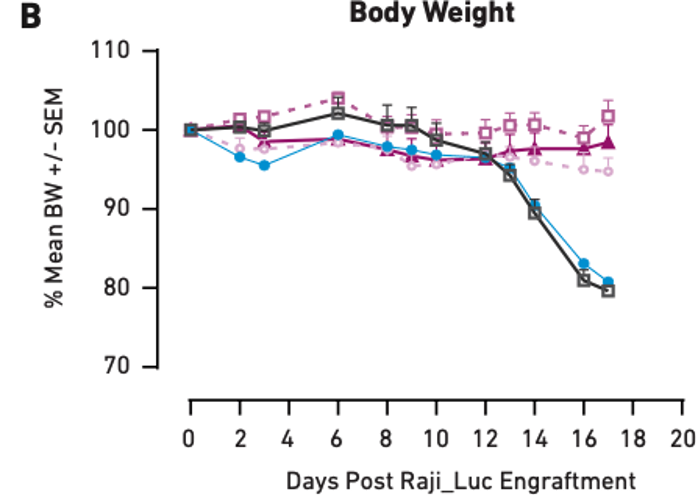
图1:使用相同供体PBMC人源化并用不同剂量CAR T细胞处理的小鼠中的肿瘤生长抑制 (A) 和体重 (B)。仅使用PBS和PBMC处理的小鼠作为阴性对照。在本例中,体重减轻与肿瘤负荷增加相关。
图1A显示,随着CAR T细胞剂量从100万个细胞增加到500万个细胞,肿瘤生长抑制也增加,表明治疗剂量和肿瘤生长减少之间具有相关性。CAR T细胞治疗的临床应用中也观察到了相似的相关性,因此我们可以认为小鼠准确地模拟了直接结果。在健康影响方面也观察到相似结果:图1B显示,未接受CAR T细胞处理(而是仅接受 PBS 和 PBMC)的小鼠出现了显著的肿瘤负荷诱导的体重减轻,而三个CAR T细胞治疗组均未出现体重减轻或只有轻微减轻,与上述肿瘤生长影响的观察结果相符。以上数据表明PBMC人源化小鼠对CAR T细胞治疗表现出剂量依赖性反应,符合临床预期。
让毒性观察结果更稳定
在使用PBMC人源化小鼠平台的补充验证研究中,研究人员发现增加用于人源化小鼠的PBMC数量可以产生更强的毒性作用。此举增加了循环CD19 + B细胞的数量,而这些细胞正是研究中给予的自体CAR T细胞的靶标。
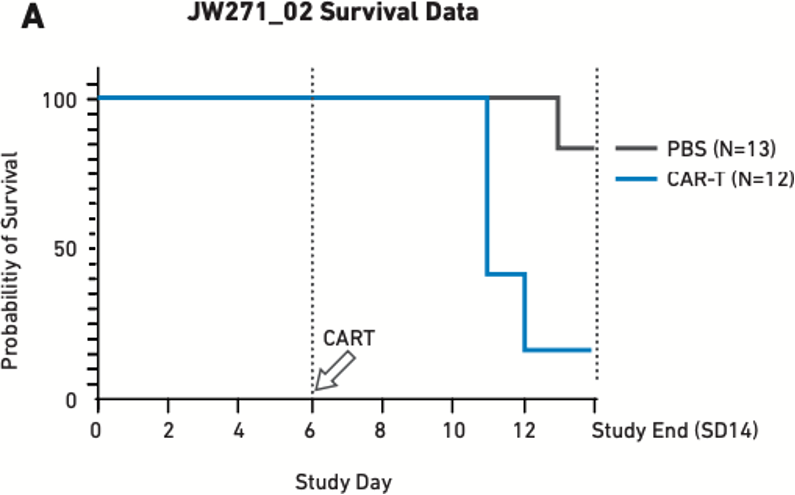
图2:用17 x 106 PBMC人源化并在6天后使用5 x 106 自体CAR T细胞(其他验证研究中使用的最低CAR T细胞剂量)处理的小鼠的存活率 (A) 和细胞因子释放数据 (B)。PBS为阴性对照组。
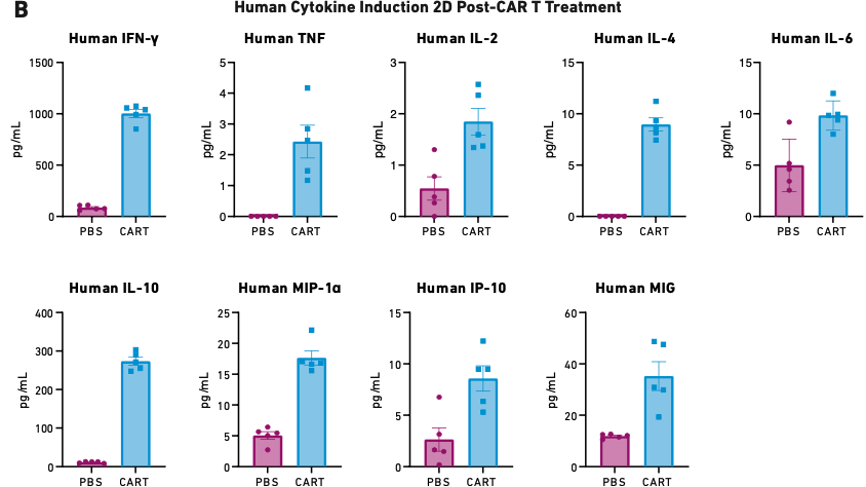
如图2A所示,15%接受CAR T细胞处理的小鼠在第14天研究完成前达到终点。此外,接受 CAR T 细胞处理的小鼠也表现出极高水平的细胞因子释放(图2B),并因此引发了严重的 CRS 和其他下游毒性。
对于研究人员而言,能可靠地产生稳定毒性反应的PBMC人源化小鼠无疑是研究CRS以及其他CAR T细胞相关毒性的有利工具,可用于在从整个器官到分子机制的多个生物学水平研究。此类研究能帮助我们了解到在临床实践中应对这种毒性的预防或治疗策略。
确定供体特异性安全性特征
研究人员发现,在使用来自不同供体的PBMC进行人源化之后,小鼠对免疫刺激的反应具有可重现变异[5]。这种供体特异性变异可用于模拟对CAR T细胞治疗的不同个体反应。科学家们可以根据观察到的不同效应,对预先表征的人类供体的生物学特征进行比较,从而确定可能导致毒性风险升高的因素。这种类型的研究可以确定CAR T细胞治疗试验的入选/排除标准,并最终为临床医生提供指导,帮助其初步判断CAR T细胞治疗是否是患者的最佳治疗选择。
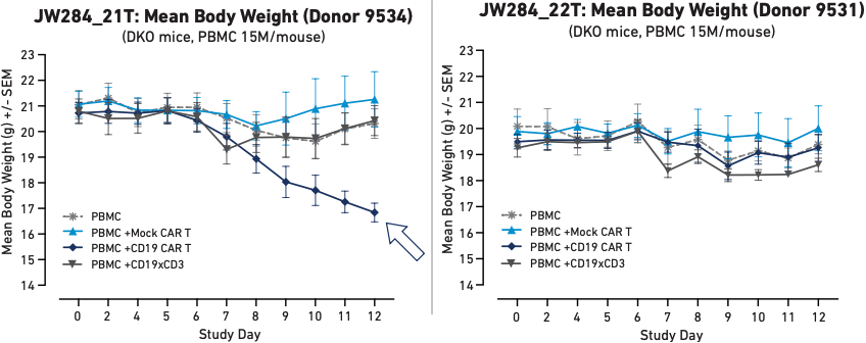
图3:不同PBMC供体的人源化小鼠在接受Mock CAR T、CD19 CAR T或CD19xCD3双特异性T细胞衔接抗体后的体重。其中,供体9534人源化小鼠在接受CAR T处理后出现全身毒性细胞因子反应,导致严重体重减轻。
图3显示了在使用两种不同PBMC供体人源化的小鼠中观察到的不同健康结果。使用供体9534的PBMC人源化的小鼠(图3A)在接受自体CAR T细胞处理后体重急剧下降,而使用供体9531的PBMC人源化的小鼠(图3B)未发生相同的体重下降。
以上结果表明,PBMC 人源化小鼠能够模拟人类供体之间的全身效应差异。
得益于小鼠反映这种多样性的能力,研究人员能够在临床环境下实施CAR T细胞疗法之前获得更多的整体数据。我们可以借助该体内平台来研发精准医学方法,以期有朝一日使用CAR T细胞治疗包括癌症在内的多种疾病。在给予临床治疗前,医生可以使用患者的PBMC人源化小鼠进行研究,从而个性化地预测CAR T细胞治疗是否对该特定患者安全有效。如果人源化小鼠研究显示患者不是CAR T细胞疗法的适当候选者,医生可以避免将患者暴露于不必要的风险,并迅速转向其他治疗方案,以免浪费宝贵的时间。
拓展CAR T细胞疗法的视野
PBMC人源化小鼠为开发、测试和改良新型CAR T细胞疗法提供了一个理想的平台,可以避免潜在的风险危及人类临床试验参与者。
同种异体CAR T细胞
如今临床上使用的所有CAR T细胞疗法都采用自体细胞,也就是为每个患者定制的个性化治疗,具体方法是将T细胞从患者体内取出,对其进行基因修饰以表达CAR蛋白,然后扩增细胞并将其回输到患者体内。然而,这种个体化方案也意味着制造过程缓慢且成本极高,可及性较低并且患者可能无法及时接受有效治疗。
许多生物制药研究人员正在积极尝试开发同种异体CAR T细胞,这将成为一种现成的治疗选择,可以更快地递送,并且成本更低。然而,这些细胞对患者的身体而言属于异物,因此可能存在遭到免疫系统破坏而失去治疗效果甚至引起危险免疫应答(如重度CRS或GvHD)的风险。因此,这些细胞很难在不给临床受试者带来巨大风险的情况下进行测试。
借助PBMC人源化小鼠,科学家们能够在多个群体中测试同种异体CAR T细胞,从而更全面、更准确地了解不同患者群体在临床中可能出现的不同反应。该平台还可用于为同种异体CAR T细胞的设计提供数据指导,以尽量避免细胞与相当广泛的人免疫系统发生反应。
经过修饰的CAR结构
研究表明,CAR在CAR T细胞上的结构和分布可影响其行为,并可能影响其疗效。6CAR蛋白的高表达可导致抗原非依赖性强直信号传导和激活,而单个结构域的结构可影响靶标识别和持久性等因素。研究人员可以通过基因工程修饰这些结构特征,构建新型CAR T细胞,从而克服目前所面临的诸如浸润实体瘤微环境的挑战。
PBMC人源化小鼠可作为临床前平台,用于测试这种结构变化对细胞的全身体内行为所产生的影响,包括疗效、与其他免疫细胞的相互作用等。
PBMC人源化小鼠是CAR T细胞治疗表征、安全性和有效性测试的理想选择。研究人员可以通过该平台全面地模拟人体对CAR T细胞治疗的免疫应答,克服其他试验方法的局限性,如成本、速度、伦理问题和在捕获人特异性全身反应方面的不足之处。我们可以在这些小鼠体内植入肿瘤,以便同时进行疗效检测和毒性分析,而这些小鼠在验证研究中对CAR T细胞给药的反应表明,它们可以为包含新型CAR T细胞研发在内的多种研究应用提供具有转化相关性的结果。
借助这些小鼠模型,生物制药领导者可以与经验丰富的研究伙伴合作,由对方提供从研究设计到数据分析的端到端支持,从而更快地迎来免疫疗法的新篇章,同时确保患者和临床试验参与者的安全。
[1] Santomasso, B., Bachier, C., Westin, J., Rezvani, K., & Shpall, E. J. (2019, May 17).The other side of CAR T-cell therapy: Cytokine release syndrome, neurologic toxicity, and financial burden.American Society of Clinical Oncology Educational Book, (39), 433–444.
https://ascopubs.org/doi/full/10.1200/EDBK_238691
[2] Eastwood, D., Findlay, L., Poole, S., Bird, C., Wadhwa, M., Moore, M., Burns, C., Thorpe, R., & Stebbings, R. (2010, October).Monoclonal antibody TGN1412 trial failure explained by species differences in CD28 expression on CD4+ effector memory T-cells.British Journal of Pharmacology, 161(3), 512–526.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2990151
[3] Matas-Céspedes A, Brown L, Mahbubani KT, Bareham B, Higgins J, Curran M, de Haan L, Lapointe JM, Stebbings R, Saeb-Parsy K. Use of human splenocytes in an innovative humanised mouse model for prediction of immunotherapy-induced cytokine release syndrome.Clin Transl Immunology.2020 Nov 4;9(11):e1202. doi: 10.1002/cti2.1202.PMID: 33173582; PMCID: PMC7641894.
[4] Brehm, M. A., Kenney, L. L., Wiles, M. V., Low, B. E., Tisch, R. M., Burzenski, L., Mueller, C., Greiner, D. L., & Shultz, L. D. (2019).Lack of acute xenogeneic graft- versus-host disease, but retention of T-cell function following engraftment of human peripheral blood mononuclear cells in NSG mice deficient in MHC class I and II expression.FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 33(3), 3137–3151.
https://doi.org/10.1096/fj.201800636R
[5] Ye, C., Yang, H., Cheng, M., Shultz, L. D., Greiner, D. L., Brehm, M. A., & Keck, J. G. (2020, August 9).A rapid, sensitive, and reproducible in vivo PBMC humanized murine model for determining therapeutic-related cytokine release syndrome.The FASEB Journal, 34(9), 12963–12975.
https://faseb.onlinelibrary.wiley.com/doi/
10.1096/fj.202001203R
[6] Stoiber, S., Cadilha, B. L., Benmebarek, M. R., Lesch, S., Endres, S., & Kobold, S. (2019).Limitations in the Design of Chimeric Antigen Receptors for Cancer Therapy.Cells, 8(5), 472.
https://doi.org/10.3390/cells8050472

